গ্যাসের দুটি অবস্থার মধ্যে অ্যাডিয়াব্যাটিক স্থানান্তর আইসোপ্রসেসের মধ্যে একটি নয়, তবে, এটি শুধুমাত্র বিভিন্ন প্রযুক্তিগত প্রক্রিয়াতেই নয়, প্রকৃতিতেও একটি গুরুত্বপূর্ণ ভূমিকা পালন করে। এই নিবন্ধে, আমরা এই প্রক্রিয়াটি কী তা বিবেচনা করব, এবং একটি আদর্শ গ্যাসের জন্য adiabatic সমীকরণও দেব।
সংক্ষেপে আদর্শ গ্যাস
একটি আদর্শ গ্যাস হল এমন যেটির কণার মধ্যে কোন মিথস্ক্রিয়া নেই এবং তাদের আকার শূন্যের সমান। প্রকৃতিতে, অবশ্যই, কোনও একশ শতাংশ আদর্শ গ্যাস নেই, যেহেতু তারা সমস্ত অণু এবং আকারের পরমাণু দ্বারা গঠিত, যা সর্বদা অন্তত ভ্যান ডার ওয়ালস বাহিনীর সাহায্যে একে অপরের সাথে যোগাযোগ করে। তা সত্ত্বেও, বর্ণিত মডেলটি অনেক বাস্তব গ্যাসের ব্যবহারিক সমস্যা সমাধানের জন্য যথেষ্ট নির্ভুলতার সাথে সঞ্চালিত হয়।
একটি আদর্শ গ্যাসের প্রধান সমীকরণ হল ক্ল্যাপেয়ারন-মেন্ডেলিভ আইন। এটি নিম্নলিখিত আকারে লেখা আছে:
PV=nRT.
এই সমীকরণটি পণ্যের মধ্যে একটি সরাসরি আনুপাতিকতা স্থাপন করেভলিউম V-এর উপর P চাপ এবং পরম তাপমাত্রা T-এ পদার্থ n-এর পরিমাণ। R-এর মান হল গ্যাসের ধ্রুবক, যা একটি আনুপাতিকতা ফ্যাক্টরের ভূমিকা পালন করে।
এডিয়াব্যাটিক প্রক্রিয়া কি?
একটি diabatic প্রক্রিয়া হল একটি গ্যাস সিস্টেমের অবস্থার মধ্যে একটি রূপান্তর যেখানে পরিবেশের সাথে শক্তির কোন বিনিময় নেই। এই ক্ষেত্রে, সিস্টেমের তিনটি থার্মোডাইনামিক বৈশিষ্ট্য (P, V, T) পরিবর্তিত হয় এবং n পদার্থের পরিমাণ স্থির থাকে।
এডিয়াব্যাটিক প্রসারণ এবং সংকোচনের মধ্যে পার্থক্য করুন। উভয় প্রক্রিয়া শুধুমাত্র সিস্টেমের অভ্যন্তরীণ শক্তির কারণে ঘটে। সুতরাং, প্রসারণের ফলে, চাপ এবং বিশেষত সিস্টেমের তাপমাত্রা নাটকীয়ভাবে হ্রাস পায়। বিপরীতভাবে, এডিয়াব্যাটিক কম্প্রেশনের ফলে তাপমাত্রা এবং চাপের ইতিবাচক লাফানো হয়।
পরিবেশ এবং সিস্টেমের মধ্যে তাপ বিনিময় রোধ করতে, পরবর্তীতে অবশ্যই তাপ নিরোধক দেয়াল থাকতে হবে। উপরন্তু, প্রক্রিয়ার সময় কমিয়ে দিলে তাপ প্রবাহ সিস্টেমে এবং সেখান থেকে উল্লেখযোগ্যভাবে কমে যায়।
এডিয়াব্যাটিক প্রক্রিয়ার জন্য বিষ সমীকরণ

তাপগতিবিদ্যার প্রথম সূত্রটি নিম্নরূপ লেখা হয়:
Q=ΔU + A.
অন্য কথায়, সিস্টেমের সাথে যোগাযোগ করা তাপ Q সিস্টেম দ্বারা A কাজ সম্পাদন করতে এবং এর অভ্যন্তরীণ শক্তি ΔU বৃদ্ধি করতে ব্যবহৃত হয়। adiabatic সমীকরণ লিখতে, একজনকে Q=0 বসাতে হবে, যা অধ্যয়নের অধীনে প্রক্রিয়াটির সংজ্ঞার সাথে মিলে যায়। আমরা পাই:
ΔU=-A.
আইসোকোরিক সহএকটি আদর্শ গ্যাসে প্রক্রিয়া, সমস্ত তাপ অভ্যন্তরীণ শক্তি বাড়াতে যায়। এই সত্য আমাদের সমতা লিখতে অনুমতি দেয়:
ΔU=CVΔT.
যেখানে CV হল আইসোকোরিক তাপ ক্ষমতা। কাজ A, ঘুরে, নিম্নরূপ গণনা করা হয়:
A=PdV.
যেখানে dV একটি ছোট ভলিউম পরিবর্তন।
ক্লেপেয়ারন-মেন্ডেলিভ সমীকরণ ছাড়াও, নিম্নলিখিত সমীকরণটি একটি আদর্শ গ্যাসের জন্য ধারণ করে:
CP- CV=R.
যেখানে CP হল আইসোবারিক তাপ ক্ষমতা, যা সর্বদা আইসোকোরিকের চেয়ে বেশি, কারণ এটি প্রসারণের কারণে গ্যাসের ক্ষতি বিবেচনা করে।
উপরে লেখা সমীকরণগুলি বিশ্লেষণ করে এবং তাপমাত্রা এবং আয়তনের উপর একীভূত করে, আমরা নিম্নলিখিত adiabatic সমীকরণে পৌঁছেছি:
TVγ-1=কন্সট।
এখানে γ হল diabatic সূচক। এটি আইসোকোরিক থেকে আইসোবারিক তাপ ক্ষমতার অনুপাতের সমান। এই সমতাকে একটি diabatic প্রক্রিয়ার জন্য Poisson সমীকরণ বলা হয়। Clapeyron-Mendeleev আইন প্রয়োগ করে, আপনি আরও দুটি অনুরূপ অভিব্যক্তি লিখতে পারেন, শুধুমাত্র P-T এবং P-V পরামিতিগুলির মাধ্যমে:
TPγ/(γ-1)=const;
PVγ=কন্সট।
Adiabatic গ্রাফ বিভিন্ন অক্ষে দেওয়া যেতে পারে। নীচে এটি P-V অক্ষে দেখানো হয়েছে৷
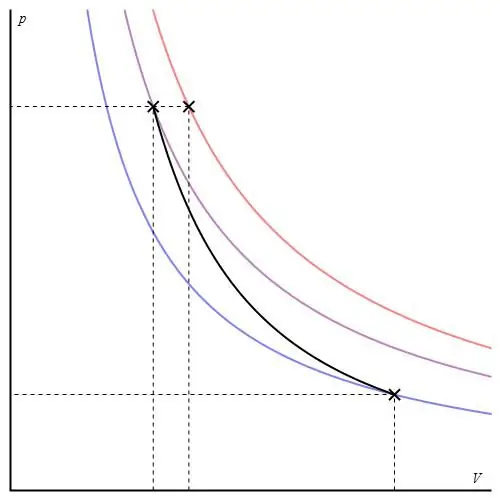
গ্রাফের রঙিন রেখাগুলি আইসোথার্মের সাথে মিলে যায়, কালো বক্ররেখা হল একটি অডিবাট। দেখা যায়, আদিয়াবাট যে কোনো আইসোথার্মের চেয়ে বেশি তীক্ষ্ণভাবে আচরণ করে। এই সত্যটি ব্যাখ্যা করা সহজ: আইসোথার্মের জন্য, চাপ আবার পরিবর্তিত হয়আয়তনের সমানুপাতিক, কিন্তু আইসোবাথের জন্য, চাপ দ্রুত পরিবর্তিত হয়, যেহেতু যে কোনো গ্যাস সিস্টেমের জন্য সূচকটি γ>1।
উদাহরণ সমস্যা
প্রকৃতিতে, পার্বত্য অঞ্চলে, যখন বায়ু ভর ঢালের উপরে চলে যায়, তখন এর চাপ কমে যায়, এটি আয়তনে বৃদ্ধি পায় এবং শীতল হয়। এই adiabatic প্রক্রিয়া শিশির বিন্দু কমিয়ে তরল এবং কঠিন বৃষ্টিপাত তৈরি করে।

নিম্নলিখিত সমস্যার সমাধান করার জন্য প্রস্তাব করা হয়েছে: পর্বতের ঢাল বরাবর বায়ু ভর উত্তোলনের প্রক্রিয়ায়, পায়ের চাপের তুলনায় চাপ 30% কমে গেছে। পাদদেশে 25 oC হলে এর তাপমাত্রা কত হবে?
সমস্যা সমাধান করতে, নিম্নলিখিত adiabatic সমীকরণটি ব্যবহার করুন:
TPγ/(γ-1)=কন্সট।
এই ফর্মে লিখলে ভালো হয়:
T2/T1=(P2/P 1)(γ-1)/γ.
যদি P1কে 1 বায়ুমণ্ডল হিসেবে নেওয়া হয়, তাহলে P2 হবে 0.7 বায়ুমণ্ডলের সমান। বায়ুর জন্য, diabatic সূচক 1.4, যেহেতু এটি একটি ডায়াটমিক আদর্শ গ্যাস হিসাবে বিবেচিত হতে পারে। T1 এর তাপমাত্রা মান হল 298.15 K। উপরের অভিব্যক্তিতে এই সমস্ত সংখ্যা প্রতিস্থাপন করলে আমরা পাই T2=269.26 K, যা এর সাথে মিলে যায় - 3, 9 oC.






