আদর্শ গ্যাস, রাষ্ট্রের আদর্শ গ্যাস সমীকরণ, এর তাপমাত্রা এবং চাপ, আয়তন… পদার্থবিদ্যার সংশ্লিষ্ট বিভাগে ব্যবহৃত পরামিতি এবং সংজ্ঞাগুলির তালিকাটি দীর্ঘ সময়ের জন্য চালিয়ে যেতে পারে। আজ আমরা এই বিষয়ে কথা বলব।
আণবিক পদার্থবিজ্ঞানে কী বিবেচনা করা হয়?

এই বিভাগে বিবেচিত মূল বস্তুটি হল একটি আদর্শ গ্যাস। রাষ্ট্রের আদর্শ গ্যাস সমীকরণটি স্বাভাবিক পরিবেশগত পরিস্থিতি বিবেচনায় নিয়ে প্রাপ্ত হয়েছিল এবং আমরা এই সম্পর্কে একটু পরে কথা বলব। এখন দূর থেকে এই "সমস্যা" এর কাছে যাওয়া যাক।
ধরা যাক আমাদের কিছু ভরের গ্যাস আছে। একটি থার্মোডাইনামিক প্রকৃতির তিনটি পরামিতি ব্যবহার করে এর অবস্থা নির্ধারণ করা যেতে পারে। এগুলো অবশ্যই চাপ, আয়তন এবং তাপমাত্রা। এই ক্ষেত্রে সিস্টেমের অবস্থার সমীকরণটি সংশ্লিষ্ট পরামিতিগুলির মধ্যে সম্পর্কের সূত্র হবে। এটি এইরকম দেখাচ্ছে: F (p, V, T)=0.
এখানে, প্রথমবারের মতো, আমরা ধীরে ধীরে আদর্শের মতো একটি জিনিসের আবির্ভাবের দিকে এগিয়ে যাচ্ছিগ্যাস এটিকে এমন গ্যাস বলা হয় যেখানে অণুগুলির মধ্যে মিথস্ক্রিয়া নগণ্য। সাধারণভাবে, এটি প্রকৃতিতে বিদ্যমান নেই। যাইহোক, যে কোন অত্যন্ত বিরল গ্যাস এর কাছাকাছি। নাইট্রোজেন, অক্সিজেন এবং বায়ু, যা স্বাভাবিক অবস্থায় থাকে, আদর্শ থেকে সামান্য ভিন্ন। একটি আদর্শ গ্যাসের জন্য রাষ্ট্রের সমীকরণ লিখতে, আমরা ইউনিফাইড গ্যাস আইন ব্যবহার করতে পারি। আমরা পাই: pV/T=const.
সম্পর্কিত ধারণা 1: অ্যাভোগাড্রোর আইন
তিনি আমাদের বলতে পারেন যে আমরা যদি একেবারে যেকোন এলোমেলো গ্যাসের একই সংখ্যক মোল গ্রহণ করি এবং তাপমাত্রা এবং চাপ সহ একই অবস্থায় রাখি, তবে গ্যাসগুলি একই আয়তন দখল করবে। বিশেষ করে, পরীক্ষাটি স্বাভাবিক অবস্থায় করা হয়েছিল। এর মানে হল যে তাপমাত্রা ছিল 273.15 কেলভিন, চাপ ছিল একটি বায়ুমণ্ডল (760 মিলিমিটার পারদ, বা 101325 প্যাসকেলস)। এই পরামিতিগুলির সাথে, গ্যাসটি 22.4 লিটারের সমান ভলিউম দখল করেছে। অতএব, আমরা বলতে পারি যে কোনো গ্যাসের এক মোলের জন্য, সংখ্যাগত পরামিতিগুলির অনুপাত একটি ধ্রুবক মান হবে। এই কারণেই এই চিত্রটিকে R অক্ষর দিয়ে মনোনীত করার এবং এটিকে সর্বজনীন গ্যাস ধ্রুবক বলার সিদ্ধান্ত নেওয়া হয়েছিল। সুতরাং, এটি 8.31 এর সমান। একক হল J/molK।
আদর্শ গ্যাস। রাষ্ট্রের আদর্শ গ্যাস সমীকরণ এবং এর হেরফের
আসুন সূত্রটি আবার লেখার চেষ্টা করি। এটি করার জন্য, আমরা এটি এই ফর্মটিতে লিখি: pV=RT। এর পরে, আমরা একটি সাধারণ ক্রিয়া সম্পাদন করি, সমীকরণের উভয় দিককে নির্বিচারে মোলের সংখ্যা দ্বারা গুণ করি। আমরা pVu=uRT পাই। আসুন আমলে নেওয়া যাক যে মোলার আয়তনের গুণফল এবংপদার্থের পরিমাণ কেবল আয়তন। কিন্তু সর্বোপরি, মোলের সংখ্যা একই সাথে ভর এবং মোলার ভরের ভাগফলের সমান হবে। মেন্ডেলিভ-ক্লেপিরন সমীকরণটি ঠিক এই রকম। এটি একটি আদর্শ গ্যাস ফর্ম কি ধরনের সিস্টেমের একটি পরিষ্কার ধারণা দেয়। একটি আদর্শ গ্যাসের জন্য রাষ্ট্রের সমীকরণটি রূপ নেবে: pV=mRT/M.
চাপের সূত্র অনুমান করুন
আসুন প্রাপ্ত এক্সপ্রেশনের সাথে আরও কিছু ম্যানিপুলেশন করা যাক। এটি করার জন্য, মেন্ডেলিভ-ক্ল্যাপেয়ারন সমীকরণের ডানদিকে অ্যাভোগাড্রো সংখ্যা দ্বারা গুণিত এবং ভাগ করা হয়। এখন আমরা মনোযোগ সহকারে অ্যাভোগাড্রো সংখ্যা দ্বারা পদার্থের পরিমাণের গুণফলটি দেখি। এটি গ্যাসের মোট অণুর সংখ্যা ছাড়া আর কিছুই নয়। কিন্তু একই সময়ে, অ্যাভোগাড্রো সংখ্যার সাথে সার্বজনীন গ্যাস ধ্রুবকের অনুপাত বোল্টজম্যান ধ্রুবকের সমান হবে। অতএব, চাপের সূত্রগুলি নিম্নরূপ লেখা যেতে পারে: p=NkT/V বা p=nkT। এখানে প্রতীক n হল কণার ঘনত্ব।
আদর্শ গ্যাস প্রক্রিয়া
আণবিক পদার্থবিজ্ঞানে আইসোপ্রসেসের মতো একটি জিনিস রয়েছে। এগুলি হল থার্মোডাইনামিক প্রক্রিয়া যা ধ্রুবক পরামিতিগুলির একটিতে সিস্টেমে সঞ্চালিত হয়। এই ক্ষেত্রে, পদার্থের ভরও স্থির থাকতে হবে। আসুন আরো নির্দিষ্টভাবে তাদের তাকান. সুতরাং, একটি আদর্শ গ্যাসের নিয়ম।
চাপ স্থির থাকে
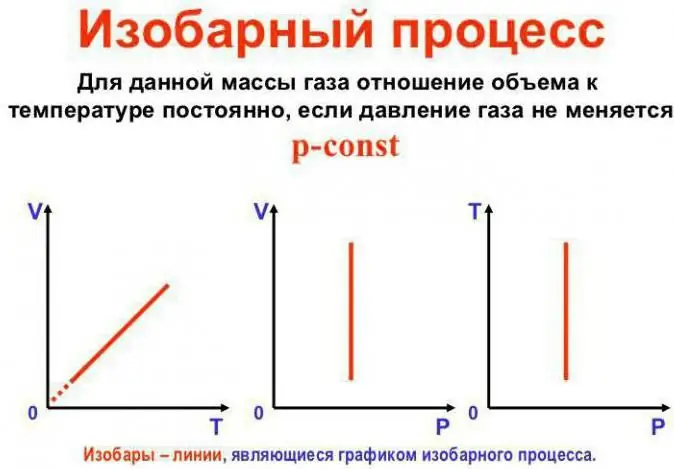
এটি গে-লুসাকের আইন। এটা এই মত দেখায়: V/T=const. এটি অন্য উপায়ে পুনরায় লেখা যেতে পারে: V=Vo (1 + at)। এখানে a 1/273.15 K^-1 এর সমান এবং একে "ভলিউম এক্সপেনশন সহগ" বলা হয়। আমরা উভয় সেলসিয়াস এবং তাপমাত্রা প্রতিস্থাপন করতে পারেনকেলভিন স্কেল। পরবর্তী ক্ষেত্রে, আমরা V=Voat সূত্র পাই।
ভলিউম স্থির থাকে

এটি গে-লুসাকের দ্বিতীয় আইন, যাকে সাধারণত চার্লসের আইন বলা হয়। এটা এই মত দেখায়: p/T=const. আরেকটি সূত্র আছে: p=po (1 + at)। রূপান্তর পূর্ববর্তী উদাহরণ অনুযায়ী বাহিত হতে পারে. আপনি দেখতে পাচ্ছেন, আদর্শ গ্যাস আইন কখনও কখনও একে অপরের সাথে বেশ মিল থাকে৷
তাপমাত্রা স্থির থাকে

যদি একটি আদর্শ গ্যাসের তাপমাত্রা স্থির থাকে, তাহলে আমরা বয়েল-মেরিওট সূত্র পেতে পারি। এটি এভাবে লেখা যেতে পারে: pV=const.
সম্পর্কিত ধারণা 2: আংশিক চাপ
ধরা যাক আমাদের গ্যাস সহ একটি জাহাজ আছে। এটি একটি মিশ্রণ হবে। সিস্টেমটি তাপীয় ভারসাম্যের অবস্থায় রয়েছে এবং গ্যাসগুলি একে অপরের সাথে প্রতিক্রিয়া করে না। এখানে N মোট অণুর সংখ্যা নির্দেশ করবে। N1, N2 এবং তাই, যথাক্রমে, মিশ্রণের প্রতিটি উপাদানে অণুর সংখ্যা। চাপের সূত্র p=nkT=NkT/V ধরি। এটি একটি নির্দিষ্ট ক্ষেত্রে খোলা যেতে পারে। একটি দুই-উপাদান মিশ্রণের জন্য, সূত্রটি রূপ নেবে: p=(N1 + N2) kT/V। কিন্তু তারপর দেখা যাচ্ছে যে প্রতিটি মিশ্রণের আংশিক চাপ থেকে মোট চাপ যোগ করা হবে। সুতরাং, এটি p1 + p2 এর মতো দেখতে হবে এবং আরও অনেক কিছু। এগুলো হবে আংশিক চাপ।
এটা কিসের জন্য?
আমরা যে সূত্রটি পেয়েছি তা নির্দেশ করে যে সিস্টেমে চাপ প্রতিটি অণুর গ্রুপ থেকে। ঘটনাক্রমে, এটি নির্ভর করে নাঅন্যান্য. ডাল্টন আইন প্রণয়নের সময় এর সুবিধা নিয়েছিলেন, পরে তার নামকরণ করা হয়েছিল: একটি মিশ্রণে যেখানে গ্যাসগুলি একে অপরের সাথে রাসায়নিকভাবে বিক্রিয়া করে না, মোট চাপ হবে আংশিক চাপের সমষ্টির সমান।






